Meer dan 70% van de borstkankerpatiënten heeft een hormoonreceptorpositieve ziekte; estrogeenreceptorpositief (ER+), progesteronreceptorpositief (PgR+) of beide. ER-positiviteit is een belangrijke voorspeller voor de gevoeligheid van een patiënt voor endocriene therapie, maar deze therapie is niet bij alle ER+-borstkankers even effectief. Dr. Farrokh Dehadashti en collega’s trachtten daarom preciezere prognostische factoren vast te stellen om beter te kunnen voorspellen of een borstkankerpatiënt zal reageren op de endocriene therapie. De resultaten werden in februari gepubliceerd in Nature Communications.
De onderzoekers hadden de hypothese dat ze met een oestradioltoediening konden testen of de borstkankerpatiënten zouden reageren op endocriene therapie. De transcriptie van PgR wordt direct gereguleerd door oestrogeen en wordt daarom alleen verhoogd wanneer ER functioneel is en er dus oestrogeen aanwezig is. Eerdere studies die PgR-waardes gebruikten om de functionele staat van ER te bepalen, liepen echter tegen verschillende problemen aan, zoals verlaagde oestrogeenniveaus tijdens de menopauze, welke de PgR-niveaus mogelijk niet maximaal verhogen, hoewel lokale niveaus van oestradiol mogelijk wel hoger zijn.
De onderzoeksgroep van dr. Dehadashti koos er daarom voor om zelf een PgR-bindend progesteron te ontwikkelen (21-[18F]fluorofuranylnorprogesterone [FFNP]) die significant beter werd opgenomen door PgR+-tumoren in vergelijking met PgR—-tumoren, zoals gezien op PET-scans. Deze FFNP-PET-methode werd vervolgens in een fase II-studie ingezet om te bepalen of het mogelijk is om hiermee te voorspellen of borstkankerpatiënten zouden gaan reageren op endocriene therapie. Er werd onderzocht of ER functioneel was door kort oestradiol toe te dienen en daarna PgR-tumorniveaus te meten, de zogenaamde PgR-gebaseerde oestradiol-‘challenge’. Dit niveau werd vergeleken met de PgR-niveaus bij baseline. Totaal ondergingen 43 vrouwelijke borstkankerpatiënten deze nieuwe imagingmethode.
De receptorstatus van de primaire tumor werd bepaald; alle tumoren waren ER+ en 27 waren PgR+. De imaging-data werd verkregen op 134 verschillende plaatsen waaronder bot (n=70), lymfeklieren (n=32) en borstwand (n=18). Elf patiënten rapporteerden graad 1 (o.a. diarree en misselijkheid) of graad 2 (o.a. braken en krampen) bijwerkingen bij oestradioltoediening. Bij FFNP-toediening werden geen bijwerkingen genoteerd.
Van de deelnemers bleek 35% (n=15) niet te reageren op endocriene therapie en ziekteprogressie door te maken binnen 6 maanden na start van behandeling. De overige 65% (n=18) reageerden wel op de therapie, waarbij 54% een partiële respons ontwikkelde en 46% een stabiele ziekte.
De tumoropname van FFNP verschilde bij baseline niet significant tussen deelnemers die wel en niet reageerden op endocriene therapie (mediaan 3,7 versus mediaan 2,8; p=0,18). Na het toedienen van oestradiol bleek de tumoropname van FFNP wél significant verhoogd bij borstkankerpatiënten die zouden reageren op de endocriene therapie in vergelijking met niet-responders (p<0,0001). Bij veel non-responder-patiënten nam de uptake van FFNP juist af na oestradioltoediening ten op zichte van baseline. Bij patiënten die reageren op endocriene therapie nam de FFNP-opname toe met mediaan 25,4% (Q1-Q3: 11,9-35,5%), waar de FFNP-opname bij niet-responders afnam met mediaan -0,7% (Q1-Q3: -23,4 tot 0,4%).
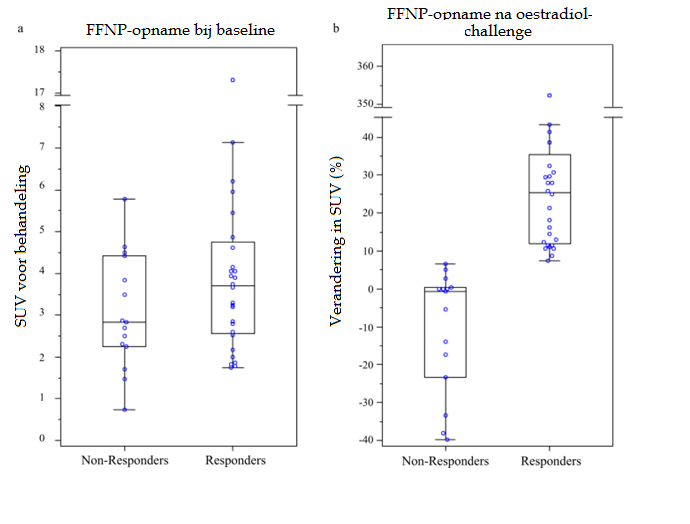
A) Gestandaardiseerde FFNP-opnamewaarde (SUV) bij baseline. B) Verschil in FFNP-opname (%) tussen baseline en na oestradioltoediening.
Bron: https://www.nature.com/articles/s41467-020-20814-9
De Europese Commissie heeft onlangs besloten tot financiering van het Europese ASCERTAIN-project. Dit project is erop gericht om meer transparantie en eenvormigheid tot stand te brengen in de waardegebaseerde prijsstelling van (dure) geneesmiddelen en verbetering van de toegang tot deze middelen binnen Europa. De financiering vanuit Horizon Europe (5 miljoen euro) geldt voor een periode van 4 jaar. ASCERTAIN wordt uitgevoerd door een samenwerkingsverband van Europese universiteiten, waarvan de Erasmus Universiteit van Rotterdam projectleider is. Het project zal volgens planning in november dit jaar officieel van start gaan.
Focus op kanker
Het project ‘Affordability and Sustainability improvements through new pricing, Cost- Effectiveness and ReimbursemenT models to Appraise iNnovative health technologies’ (ASCERTAIN) heeft ten doel om de huidige methoden van waardegebaseerde prijsstelling, kosteneffectiviteitsmodellering, drempelbepaling, en vergoeding te verbeteren, betaalbare prijzen vast te stellen en een cyclische beoordeling van bredere maatschappelijke voordelen, waaronder kosten en risico's, te faciliteren. Uiteindelijke doel is vooral de toegang en de snelheid van toegang tot deze middelen te verbeteren. De focus in het project zal liggen op innovaties op kankergebied. Hierin zal de Erasmus School of Health Policy & Management (ESHPM) en het Institute for Medical Technology Assessment (iMTA) van de Erasmus Universiteit Rotterdam gaan samenwerken met andere universiteiten in onder meer Parijs, Oslo, Innsbrück en een aantal Oost-Europese landen.
Doelstelling
In een recent interview met het Nederlands Tijdschrift voor Oncologie zegt prof.dr. Carin Uyl (hoogleraar Health Technology Assessment,directeur van het iMTA en projectleider van ASCERTAIN) daarover: “De doelstelling van dit project is om in samenwerking met Europese organisaties (waaronder vertegenwoordigers van de farmaceutische industrie, hematologen, oncologen, verzekeraars, overheid en kankerpatiënten) te komen tot een meer uniforme Europese systematiek van prijsstelling, kosteneffectiviteit en vergoeding van geneesmiddelen. Daarmee dient de toegang van geneesmiddelen voor alle Europeanen beter te worden gewaarborgd.”
Over Horizon Europe
Horizon Europe is het ambitieuze onderzoeks- en innovatieprogramma van de Europese Unie dat loopt van 2022 tot en met 2027 met doorlopende subsidieoproepen (‘calls for proposals’) en een totaal budget van ruim 95 miljard euro. De belangrijkste doelstellingen van Horizon Europe zijn:

Bovendien bleek dat alle borstkankerpatiënten die reageerden op endocriene therapie een verhoogde FFNP-opname hadden van minstens 7% (‘FFNP standardized uptake values’, SUV). Alle klinische niet-responders hadden daarentegen een SUV-verandering van minder dan 7%. Verder was de mediane algehele overleving 22,6 maanden bij patiënten die niet op endocriene therapie reageerden en nog niet gehaald bij responders (p<0,0001) na een follow-upperiode van 27,1 maanden. Er werd geen verband gezien tussen de algehele overleving en de FFNP-opname bij baseline.
De onderzoekers zagen deze bevindingen als het bewijs dat het mogelijk is om aan de hand van een FFNP-PET-scan met oestradioltoediening te bepalen of patiënten met gevorderde borstkanker zouden reageren op endocriene therapie. Tussen baseline en post-challenge werd bij alle 28 patiënten die zouden reageren op de therapie een significante toename gezien in de (FFNP) progesteronopname van de tumor. Bij geen van de 15 patiënten die niet zouden reageren op de therapie werd deze toename gezien. Dit levert een sensitiviteit én specificiteit op van 100% bij het voorspellen van behandelingsgevoeligheid voor endocriene therapie met deze methode. Een fase III-studie met een grotere groep patiënten zal verder moeten bewijzen dat deze methode geschikt is om in de klinische praktijk toegepast te worden.
Referentie